Use of Fluorescence Nanoparticle Tracking Analysis as a tool for quality assessment of EVs
세포외소포(EV)의 적절한 보관과 표준화된 조건은 바이오뱅크 임상 샘플의 안정성과 치료용 EV의 일관된 배치 생산을 위한 핵심 요소이자 전제 조건입니다[1-2]. 부적절한 보관 조건으로 인한 EV 농도 손실은 활성 감소와 물리적 무결성을 동반합니다. 결과적으로 생화학적 표현형 분석에 사용되는 표면 단백질은 분해되거나 기능이 제한될 수 있습니다[3-6].
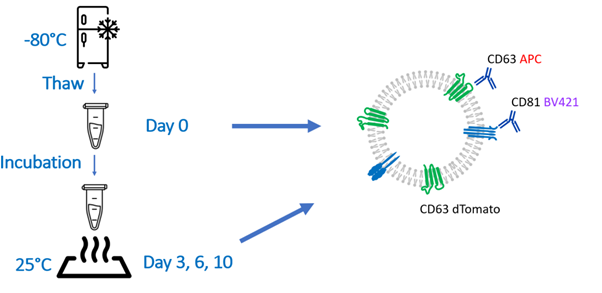
이 실험에서 CD63 dTomato를 과발현하는 HEK293T 유래 EV는 CD63 APC 및 CD81 BV421로 동시에 형광 표지 되었습니다. 라벨링(Labeling) 및 형광 NTA(F-NTA) 측정은 샘플이 해동된 직후에 수행되었습니다. 추가 소분액(Aliquot)은 해동 후 3, 6, 10일 동안 25℃에서 보관한 후 라벨링 및 F-NTA 분석을 수행했습니다.
10일의 실험 기간 내에 CD63 검출을 통해 F-NTA에서 EV 농도의 실질적인 감소가 관찰되었습니다(그림 2). 고유의 CD63 dTomato 라벨링과 비교한 CD63 APC의 라벨링 효율성은 특정 날짜에 일반적으로 거의 100%에 가까웠습니다. CD63 dTomato와 CD63 APC 농도의 단계적 감소는 관찰된 시간 간격에 걸쳐 거의 동일합니다.
이러한 결과는 실험의 신뢰성뿐만 아니라 CD63 dTomato와 CD63 APC 항체를 사용한 추가 라벨링 간의 호환성을 나타냅니다. 그러나 CD81 BV421은 시간이 지남에 따라 어떠한 감소도 나타내지 않았습니다.



해동 후 간혹 측정되는 크기의 중요한 변화는 관찰되지 않았으며 EV의 강성 / 유동성 또는 단백질 함량과 같은 막 특성에 따라 달라질 수 있습니다. 그러나 저장 시간 간격 동안 소포의 지속적인 분해가 scatter mode(산란 모드, 일반 NTA) 및 F-NTA(형광 모드)를 통해
측정된 EV 수의 감소를 담당했다고 가정할 수 있습니다.
결론
결과는 25℃ 에서 EV를 저장하면 scatter NTA(산란 모드 NTA)의 입자 수가 일정하고 지속적으로 감소할 뿐만 아니라 CD63 발현 소포가 감소한다는 것을 보여주며, 이는 관찰된 전체 입자 수의 감소가 소포의 분해로 인해 발생한다는 것을 보여줍니다.
흥미롭게도, 소포체를 발현하는 CD81의 농도는 시간이 지나도 안정적으로 유지되며 이는 이 하위 집단이 주어진 저장 조건에서 더 안정적일 수 있음을 암시합니다.
Scatter(일반 산란 모드 NTA) 및 F-NTA(형광 NTA)를 통한 농도 측정은 신속하고 신뢰할 수 있는 품질 평가를 제공할 수 있습니다. Zetaview® 나노입자추적기를 통해 하나의 EV샘플에서 크기, 농도 및 형광을 빠르게 측정할 수 있습니다.
References (참고 자료)
1. Théry et al.:
Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines
J Extracell Vesicles 2018 Nov 23; 7(1):1535750
2. Witwer et al.:
Standardization of sample collection, isolation and analysis methods in extracellular vesicle research.
Journal of Extracellular Vesicles 2013; 2:(1), https://doi.org/10.3402/jev.v2io.20360
3. Bosch et al.:
Trehalose prevents aggregation of exosomes and cryodamage.
Scientific Reports 2016; 6, 36162
4. Lener et al.:
Applying extracellular vesicles based therapeutics in clinical trials – an ISEV position paper.
Journal of Extracellular Vesicles 2015, 4, 30087.
5. Mateescu et al.:
Obstacles and opportunities in the functional analysis of extracellular vesicle RNA – an ISEV position paper.
Journal of Extracellular Vesicles 2017, 6(1),1286095.
6. Görgens et al.:
Identification of storage conditions stabilizing extracellular vesicles preparations.
Journal of Extracellular Vesicles 2022, 11:e12238.
'Particle Metrix' 카테고리의 다른 글
| 테트라스파닌 염색과 제타 전위 분석을 통한 엑소좀의 품질 평가 (0) | 2025.03.20 |
|---|---|
| Zetaview를 통한 다발성 골수종 뼈 질환과 종양 발달에 역할을 하는 엑소좀 분석 (1) | 2024.07.22 |
| 형광 NTA 분석을 이용한 EVs 내 핵산 카고의 검출 (0) | 2024.05.23 |
| QUATT Zetaview®을 이용한 25nm Quantum dot 샘플의 F-NTA 분석 (0) | 2024.04.24 |
| C-NTA(Colocalization-NTA) QUATT Zetaveiw®를 통한 다중 염색 혈소판에서 유래된 MSC-EV(중간엽 줄기세포 세포밖소포체)의 분석 (0) | 2023.05.25 |


